semana 3
3 FEBRERO
Actividad inicial:
La motivación; Cada persona tiene un propósito o una meta, la emoción de salir adelante y ser alguien en la vida.
LEYES DE LOS GASES
Ley de boyle: La presión ejercida por una fuerza física es inversamente proporcional al volumen de una masa gaseosa, siempre y cuando su temperatura se mantenga constante. O en términos más sencillos: A temperatura constante, el volumen de una masa fija de gas es inversamente proporcional a la presión que este ejerce. Matemáticamente se puede expresar así: PV = k donde k es cosntante si la temperatura y la masa del gas permanecen constanteBoyle. Fue descubierta por Robert Boyle en 1662. Edme Mariotte también llegó a la misma conclusión que Boyle, pero no publicó sus trabajos hasta 1676. Esta es la razón por la que en muchos libros encontramos esta ley con el nombre de Ley de Boyle y Mariotte. La ley de Boyle establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando la temperatura es constante. La expresión matemática de la ley de Boyle indica que el producto de la presión de un gas por su volumen es constante:
PV= K
P1V1= P2V2
Como muestra la figura 1, Cuando se somete un gas a una presión de 4 atmósferas el volumen del gas disminuye. Por lo tanto, A mayor presión menor volumen.
PV= K
P1V1= P2V2
Como muestra la figura 1, Cuando se somete un gas a una presión de 4 atmósferas el volumen del gas disminuye. Por lo tanto, A mayor presión menor volumen.

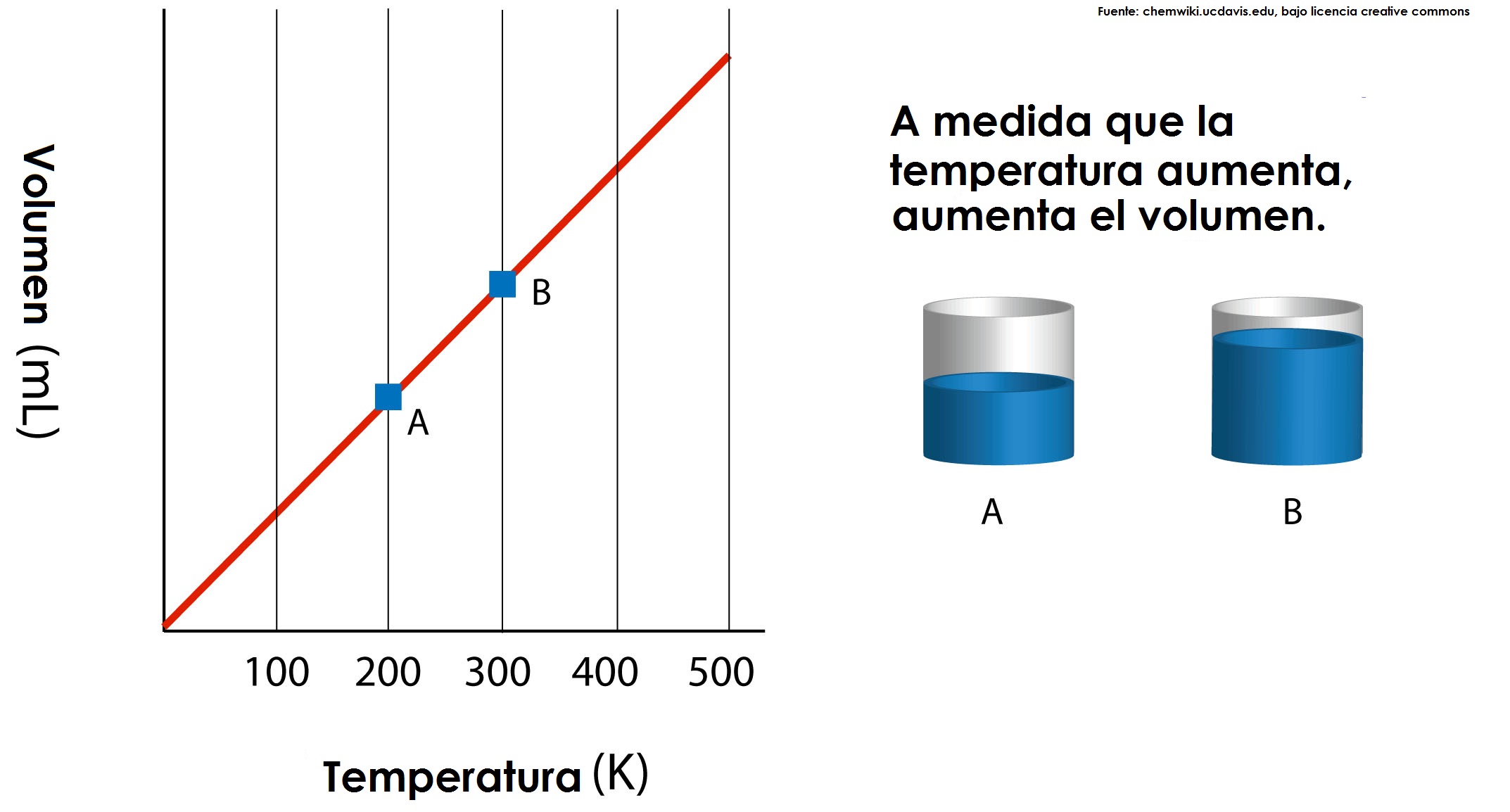
Ley de charles: En 1787, Jack Charles estudió por primera vez la relación entre el volumen y la temperatura de una muestra de gas a presión constante y observó que cuando se aumentaba la temperatura el volumen del gas también aumentaba y que al enfriar el volumen disminuía. Cuando aumentamos la temperatura del gas las moléculas se mueven con más rapidez y tardan menos tiempo en alcanzar las paredes del recipiente. Esto quiere decir que el número de choques por unidad de tiempo será mayor. Es decir se producirá un aumento (por un instante) de la presión en el interior del recipiente y aumentará el volumen (el émbolo se desplazará hacia arriba hasta que la presión se iguale con la exterior).
Lo que Charles descubrió es que si la cantidad de gas y la presión permanecen constantes, el cociente entre el volumen y la temperatura siempre tiene el mismo valor.
Matemáticamente podemos expresarlo así:
VT=kVT=k
(el cociente entre el volumen y la temperatura es constante)
Supongamos que tenemos un cierto volumen de gas V1 que se encuentra a una temperatura T1 al comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2, entonces la temperatura cambiará a T2, y se cumplirá:
V1T1=V2T2.
6 DE FEBRERO
Actividad inicial: Lo que siempre damos así sea bueno o malo se nos devuelve, siempre hay que dar cosas buenas para construir nuevas energías.
Ley de Avogadro: La ley de Avogadro afirma que las masas de un volumen patrón de diferentes gases (densidades) son proporcionales a la masa de cada molécula individual.Es decir, afirma que dos volúmenes iguales de gases diferentes contienen el mismo número de moléculas. Aunque esto sólo se observa si sus condiciones de temperatura y presión son las mismas. Por tanto, dos botellas idénticas, una llena de oxígeno y otra de helio, contendrán exactamente el mismo número de moléculas. Sin embargo, el número de átomos de oxígeno será dos veces mayor puesto que el oxígeno es diatómico.

GAS
|
FORMULA
|
MASA MOLAR
|
VOLUMEN MOLAR
|
Hidrogeno
|
H3
|
2
|
22,4
|
Helio
|
He2
|
4
|
22,4
|
Metano
|
CH4
|
16
|
22,4
|
Nitrogeno
|
N2
|
28
|
22,4
|
Oxigeno
|
O2
|
32
|
22,4
|
Ley de Dalton: Esta ley afirma que cuando dos elementos se combinan para originar diferentes compuestos, dada una cantidad fija de uno de ellos, las diferentes cantidades del otro se combinan con dicha cantidad fija para dar como producto los compuestos, están en relación de números enteros sencillos. Esta fue la última de las leyes ponderales en postularse. Dalton trabajó en un fenómeno del que Proust no se había percatado, y es el hecho de que existen algunos elementos que pueden relacionarse entre sí en distintas proporciones para formar distintos compuestos. Así, por ejemplo, hay dos óxidos de cobre, el CuO y el Cu2O, que tienen un 79,89% y un 88,82% de cobre, respectivamente, y que equivalen a 3,973 gramos de cobre por gramo de oxígeno en el primer caso y 7,945 gramos de cobre por gramo de oxígeno en el segundo. La relación entre ambas cantidades es de 1:2 como se expresa actualmente con las fórmulas de los compuestos derivados de la teoría atómica.
Ejemplo
La combinación de una misma cantidad de Carbono (12 gramos) con distintas cantidades de Oxígeno.
C + O2 ---- 12 g. de C + 32 g de O2 --- 44g.
C + ½ O2 ---- 12 g. de C + 16 g de O2 --- 28g.
Se observa que las cantidades de oxígeno mantienen la relación numérica sencilla (en este caso "el doble")
32/16 = 2
BIOLOGÍA
TEORÍA CELULAR
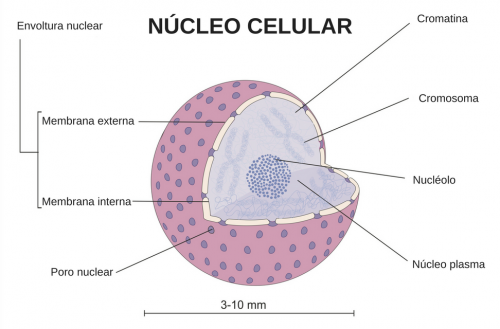
La teoría celular se basó en los adelantos realizados mediante los aparatos de observación debidos inicialmente a Robert Hooke (1635-1703) y a Antoni Van Leeuwenhoek (1632-1723). Hooke construyó cientos de microscopios. Los más avanzados estaban formados por dos lupas combinadas como ocular y objetivo (microscopio compuesto). Aunque con ellos llegó a alcanzar 250 aumentos, eran preferibles los de una sóla lente, como los que construyó van Leeuwenhoek, ya que presentaban menos aberración cromática. Con esos instrumentos consiguieron descubrir infusorios (aquellas células o microorganismos que tienen cilios u otras estructuras de motilidad para su locomoción en un medio líquido), bacterias, o la existencia de capilares en la membrana interdigital de las ranas.
Ahora sabemos que tanto los paramecios como los organismos superiores están formados por una o más células, almacenan y transportan la energía, duplican su material genético y utilizan la información que ese material contiene para sintetizar proteínas siempre de la misma forma. Todos estos procesos, que están presentes en todas las células, son los que forman la maquinaria de la vida.



Comentarios
Publicar un comentario